La uva es uno de los cultivos frutales más demandados en estos momentos. Los estudios de mejora para perfeccionar las uvas son cruciales a la hora de ofrecer al agricultor una variedad que sea lo más resistente a enfermedades y estreses bióticos que existan.
La uva es uno de los cultivos frutales más demandados en estos momentos. Los estudios de mejora para perfeccionar las uvas son cruciales a la hora de ofrecer al agricultor una variedad que sea lo más resistente a enfermedades y estreses bióticos que existan.
Desde que se introdujo el cultivo de la uva en Oriente próximo hace unos 8000 años se han obtenido relativamente pocos cruzamientos entre variedades que permitan una mayor diversidad genética que ocasione una uva «más fuerte» ante problemas que perjudiquen su desarrollo. La vid es una planta perenne que necesita de unos 3 años para que esté madura para dar esas uvas que tanto nos gustan.
Como gran ayuda en la mejora de plantas, Vitis vitifera (nombre científico de la especie de la uva «domesticada») también ha sido utilizada para multitud de estudios mediante marcadores genéticos que permiten conocer más sobre los rasgos de interés de las variedades utilizadas en los cultivares dedicados al consumo humano. Esos marcadores genéticos estarán asociados a caracteres que tengan que ver con la resistencia o susceptibilidad hacia estreses tanto bióticos (imaginad una plaga de insectos) como abióticos (un ejemplo de ellos serían las sequías). Al conocer esos marcadores y la distribución entre las variedades, permite mejorar la producción de la uva.
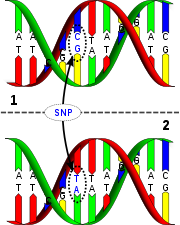
En un estudio realizado en Estados Unidos y publicado este pasado 18 de Enero en PNAS, se estudiaron unas 950 muestras de uva mediante un chip de ADN que permite examinar unos 9000 patrones de variabilidad mediante el estudio de SNPs (Polimorfismos de un único nucleótido y de los que hemos hablado en varios artículos anteriormente). Gracias a esos microarrays, los científicos desarrollaron una tabla que describe el parentesco genético de docenas de las accesiones de uva que producen algunos de los vinos más populares del mundo, incluidas uvas como Reisling o Pinot noir que son de gran interés para la producción de vino.
Los resultados del estudio fueron muy curiosos. Desde siglos pasados cuando una uva presentaba un rasgo que las distinguía de otra supuesta variedad de uva y que era beneficioso para el agricultor, se propagaba de forma vegetativa y era asignado un nuevo nombre por ese agricultor. Hay unas 10000 denominaciones de este tipo en todo el mundo actualmente, pero varias de las variedades nombradas por esa mutación encontrada y nombrada como nueva por ello son identicamente genéticas a sus parentales. O, al menos, las pruebas genéticas no pueden distinguir entre los descendientes mutantes y los parentales usados para el cruzamiento.
Sean Myles, estudiante post doctoral en la Escuela de Medicina de la Universidad de Stanford, y sus colegas advierten que el 58% de las 950 accesiones de Vitis examinadas están tan relacionadas que parecen ser clones de una única accesión. De esta forma parece que no hay tanta variabilidad como parece, al menos desde el punto de vista genético. Habría que comparar el estudio con lo que observan los sumilleres al catar el vino.
Referencias: S Myles, A. R Boyko, C. L Owens, P. J Brown, F Grassi, M. K Aradhya, B Prins, A Reynolds, J.-M Chia, D Ware, C. D Bustamante, E. S Buckler.(2011) Genetic structure and domestication history of the grape. Proceedings of the National Academy of Sciences pp. 6
Escuchando: La biblioteca de Trantor
Continue reading