La amplificación del ADN mediante PCR no podía faltar en este blog. Ya he podido comentar como se trabaja con el material hereditario anteriormente. Mejor dicho, cómo se prepara para poder sacarle partido. Para poder tener varias copias de una región específica de ADN, se utiliza la tecnología de la Reacción en Cadena de la Polimerasa (Polimerase Chain Reaction = PCR).
Contenido
Comienzos de la PCR
Este «gran invento» de la PCR se lo debemos al premiado Nobel en Química de 1993 Kary B. Mullis. Se le ocurrió realizar in vitro las condiciones necesarias para conseguir copias de fragmentos de ADN.
El ADN está en forma de doble hélice. Para que se pueda amplificar cada hebra, es necesario que se rompan los enlaces existentes para que se mantenga esa estructura. La idea consiste en reproducir ese vaivén molecular en un tubo de ensayo. Y así pudo hacerlo con la ayuda de todos los compañeros de la empresa en la que Kary B. Mullis trabajaba: Cetus Corporation.
Según nos puede contar la historia cercana de la Biología Molecular, el señor Mullis tuvo la brillante idea mientras conducía por las carreteras californianas a horas nocturnas. Observó el ir y venir de los coches cruzándose por las diferentes vías. De pronto, paró el coche y comenzó a pensar sobre el proceso de amplificación del ADN in vitro y como con tan sólo 20 ciclos podrían obtenerse la friolera de un millón de moléculas a partir de dos hebras de dicho ácido desoxirribonucleico.
Cuando volvió al trabajo lo puso en práctica. Funcionaba. La sencillez de todo el proceso hizo que hubiera muchos desconfiados dentro del ámbito de la Genética molecular. Poco tiempo después, otro premio nobel llamado Joshua Lederberg se quedó perplejo mirando el póster explicativo de Mullis con todo el proceso detallado. Le preguntó «¿funciona?», a lo que después espetó un «¿Por qué no se me habría ocurrido a mí?».
Amplificación del ADN paso a paso
Este proceso se realiza elevando la temperatura aproximadamente a 95 ºC durante un breve período de tiempo. Se denomina desnaturalización.
Posteriormente se necesita que los cebadores (oligonúcleótidos o secuencias cortas de ADN de unos 20 nucleótidos diseñadas para que flanqueen una zona específica de ADN que se quiera amplificar) se anclen a sus secuencias complementarias. L
a temperatura juega un papel importantísimo, puesto que cada pareja de cebadores (siempre se habla de parejas puesto que se debe tener un primer o cebador por un lado y otro por el otro para que se amplifique el mismo fragmento por ambos lados y producir la amplificación de la zona flanqueada) hibrida (se une al ADN) a una temperatura que, generalmente, puede variar entre 45 y 65 ºC. Aunque hay protocolos en los que se utilizan variaciones de temperatura para obtener un mejor rendimiento, pero esto lo comentaré en artículos posteriores.
Finalmente, se necesita una extensión de los fragmentos flanqueados por los primers gracias a la acción de una molécula llamada Polimerasa y que tiene su temperatura óptima de reacción a 72 ºC (aunque se utiliza también una temperatura óptima de 68 ºC, dependiendo de la casa que suministre la polimerasa).
Resumen de la PCR
Por lo tanto y en resumen se tiene en todo el proceso 3 fases:
- Desnaturalización.
- Hibridación de los cebadores.
- Extensión de los fragmentos. Al final de todo el programa, se introduce una fase de extensión más larga para que se termine de obtener un mayor número de copias.
Todo este proceso se realiza en los termocicladores: las reacciones se preparan en frío y los tubos o placas de reacción se depositan en estos aparatos que son programados para realizar los ciclos que he explicado antes. Un esquema de programa es el que pongo en la imagen siguiente:
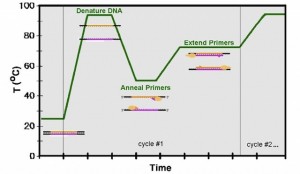
En cada ciclo de amplificación del ADN, el fragmento diana aumentará en el número de copias de forma exponencial. Esto provoca que, al final de un programa básico, se obtengan aproximadamente hasta 100 millones de copias del fragmento deseado.
Consideraciones sobre la amplificación del ADN por PCR
Las variaciones de tiempo dependen principalmente de la longitud de los fragmentos. Cuanto más tiempo mayor es el fragmento a amplificar. La clave de una buena eficiencia depende de los diseños de las reacciones de PCR que se deben ajustar a las condiciones de cada reacción.
Al principio, las polimerasas que se utilizaban no eran termorresitentes. Esto provocaba que, en cada ciclo, había que añadir polimerasa para que se pudiera extender la amplificación del ADN. Ahora se utilizan polimerasas que permiten ser añadidas en la preparación de las reacciones y se puede olvidar de ello.
No más importante, cuidado con el material a ser utilizado: el calibrado de las micropipetas es esencial y la «limpieza» del resto de materiales y lugar de trabajo pueden ser clave.
Me gustaría explicarlo todo: como se diseñan los cebadores, la realización de la reacción de PCR y todos los componentes, los estudios que se pueden derivar…etc, pero igual no acabo con el artículo y creo que la base sí que la he plasmado.
Una cosa es clara: sin la propia evolución en los conocimientos sobre el ADN y su comportamiento no se podría haber llegado a la situación de Mullis. Personas como James D. Watson, Francis Crick, Rosalind Franklin, Arthur Kornberg, H. Gobind Khorana o Thomas D. Brock tienen en sus espaldas haber sembrado poco a poco la información que ayudó a Kary B. Mullis a desarrollar su idea (que puede tener cierta controversia con el trabajo presentado por Kjell Kleppe).
Información adicional sobre la amplificación del ADN por PCR
Lo mejor es partir del propio escrito original de Kary B. Mullis. Después de generar las correspondientes patentes se puede encontrar por la red un par de documentos datados en 1986 y 1987 respectivamente con los títulos «Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction» y «Specific Synthesis of DNA in vitro via a Polymerase-Catalyzed Chain Reaction».
Otra lectura que recomiendo encarecidamente es mi monográfico dedicado a la PCR que escribí en su momento para Journal of Feelsynapsis. Como la revista se ha reconvertido en Principia, cualquiera que desee leerlo puede pedirme una copia que se la enviaré con honores.
Este vídeo explica todo bastante bien con un inglés muy fácil de seguir. Incluso se observan los fragmentos que no son específicos (que no se buscan amplificar pero que se obtienen de todas formas por la hibridación de los primers)
[youtube]http://www.youtube.com/watch?v=eEcy9k_KsDI[/youtube]
Referencia del vídeo: Essential Cell Biology, 3rd Edition. Alberts, Bray, Hopkin, Johnson, Lewis, Raff, Roberts, & Walter
Si se tuviera alguna duda al respecto, los comentarios e email están a disposición de cualquiera (y abiertos las 24 horas del día los 365 días del año).
Escuchando: el sonido de las campanas de Papá Noël…JOJOJO!!

Gracias por el aporte, me inicio en el tema y es de gran utilidad.
Edem.
Muchas gracias por el comentario, Eduardo. Si tienes alguna pregunta sobre el tema, no dudes en contactar conmigo. Suerte en tu andadura con el ADN. ;-D
Excelente….!!!! Todo en simples palabras,y define bien el concepto.
@Ana, gracias por tu comentario. No me resulta demasiado difícil explicar algo con lo que batallo todos los días. Un saludo.
Hola doctor, a ver si me puedes responder a esta pregunta, he buscado mucha información sobre la PCR pero encuentro nada. La pregunta es la siguiente: ¿Por qué la reacción de amplificación es tan específica y solo se amplifica un determinado fragmento de DNA?
Hola Andrew. La respuesta es más sencilla de lo que parece. La especificidad para anillar (acoplarse al ADN) de los primers o cebadores es enorme sobre todo al aumentar el número de nucleótidos utilizados a más de 16. Creo que con un ejemplo numérico es más sencillo: Si tiene que anillar un sólo nucleótido (A, T, c ó G), la probabilidad de que lo haga será de 1/4. Si se busca anillar dos nucleótidos (AC por ejemplo), la probabilidad será de 1/16. Si se necesita anillar 4 nucleótidos (por ejemplo el tetranúcleótido ACTG), la probabilidad de que lo haga será de 1/256. Como puedes ver, el elemento clave en el cálculo de probabilidades se obtiene por el número de elementos tomados tantas veces como sea necesario: siempre son 4 elementos, ya que se trata de los cuatro nucleótidos, y tomados 1, 2 ó 4 veces. Si utilizamos un primer o cebador con 16 nucleótidos, la probabilidad de que este oligonucleótido encuentre una zona del ADN donde se anille para amplificar será de 1/4294967296. Y cuando se realizan análisis de PCR específicos los oligonucleótidos suelen superar los 20 nucleótidos, disminuyéndose considerablemente la probabilidad anillamiento.
Espero que con esta respuesta tu duda haya sido resuelta. Un saludo 😉
Holaaaa, me gustaria que me explicaras como se pueden diseñar primers a partir de un alineamiento de proteinas. ¿Se utiliza para el diseño el alineamiento o el arbol filogenetico?
Hola, Claudia. Como tienes un alineamiento de proteínas, supongo que alguna de esas proteínas las hayas obtenido de las bases de datos. Te recuerdo que las proteínas son los productos de la expresión de secuencias de ADN conservadas. En los informes de las proteínas que hayas utilizado provenientes de las bases de datos, deben estar registradas tanto del ARN mensajero como del ADN genómico del que proceden las proteínas. Si sólo se encuentra el mensajero, al menos tienes toda la secuencia correspondiente a la expresión del gen y que es muy conservada. Lo mejor es tener la secuencia pertenecientes al ADN genómico, donde se informa de todo el gen (UTRs, intrones y exones), ya que puedes obtener un mayor rango de secuencia a partir del cuál diseñar los primers. Si puedes, obtén las secuencias nucleotídicas de los ADN genómicos correspondientes a todas las proteínas con las que alineaste la tuya y haz otro alineamiento para ver si existen más zonas no codificantes que estén conservadas y así flanquear mejor el gen de tu proteína con los primers.
Este es el procedimiento normal para obtener primers que amplifiquen debidamente el gen que codifica tu proteína. Si tienes alguna pregunta más, no dudes en comentarla. Un saludo 😉
Hola
quisiera saber si en vuestros geles de agarosa os aparecen bandas en vertical haciendo un continuo, como si fueran bandas corridas. Le doy vueltas y vueltas y no comprendo cuál es la causa.
Le he dado vueltas a todo, reactivos, tampones, cDNA, cebadores.
¿alguien puede ayudarme?
Puedo enviar foto, aunque no sé cómo
El manolete
Hola, Manolete. Una de las causas principales suele ser el exceso de ADN molde en la mezcla de reacción. Haz diluciones seriadas y prueba si ese es el problema. Si quieres enviar una foto, puedes hacerlo a la dirección contacto@blogdelaboratorio.com. Un saludo y gracias por el comentario ;).
HOla Doctor necesitoo saver si m puede explicar como es la amplificacion de fragmentos de genes mitocondriales. Le agradecería mucho..!! 😀
El ADN mitocondrial una vez aislado se amplifica de la misma forma que el ADN nuclear. Lo único que el ADN mitocondrial humano tan sólo tiene 37 genes a diferencia de los 25000 que tiene el ADN nuclear. Pero todo es igual: se extrae el ADN y se utilizan cebadores (primers, oligonucleótidos sintetizados que se unen al ADN y que flanquean la zona a amplificar) específicos de la zona a amplificar. Si tienes más preguntas no dudes en en comentármelas, Daniel. Gracias por el comentario.
Graaciias por su ayuda Doctor, a sido de mucha utilidad para elavorar mi trabajo de tesis, ahora que entiendo un poco mas del tema me basare en como aprender a hacer esas cosas.!! 😀
Quiero saber que es la amplificación de ADN
Como bien he explicado en el artículo, es obtener multitud de copias de una región específica de ADN. Gracias por el comentario.
Hola!, me gustaria saber el efecto que puede tener la metilacion del DNA en la PCR. es decir, si tengo mtlacion en el DNA a amplificar, ¿es posible que esto influya en la union de la taq polimerasa o los oligonucleotidos?, o es que la metilacion no afecta en nada? Gracias
Hola, este artículo está muy bien pero me han hecho una pregunta que no se resolver: si para obtener la huella genetica se han tenido que realizar 256 copias de una de las hebras de ADN ¿cuantos ciclos de replicación han tenido que ejecutarse?
Gracias!
¡Buenas! Un artículo increíble sin lugar a dudas. Gracias a él podré terminar un trabajo que parecía no tener fin, pero me gustaría saber para qué podemos usar la amplificación del ADN , es decir, parece una técnica bastante útil pero no me imagino en qué la podemos usar en nuestra »vida diaria». Muchas gracias.
HOLA Doctor he estado haciendo una pcr de ADN mit y no puedo obtener resultados,solo se forman dimeros de primers . Cambie la temp de HIBRIDACION,reduje el tiempo, probe con varios primers. Con un par de ellos si logre un amplificado pero se vieron varias bandas y yo solo necesito ver una. Ademas no pude replicar esa amplificacion. Por favor si tiene alguna recomendacion seria de gran utilidad. Gracias
tengo 2 consultas para hacer
1- se puede medir el peso molecular en Pb del ADN amplificado en PCR y corrido en gel de poliacrilamida, por medio de logaritmos? si es así cual es la técnica, porque no me queda muy claro.
2- he realizado las PCR y posteriores corridas electroforeticas en geles de poliacrilamida pero las bandas son demasiado tenues. Cual puede ser el problema??
Hola Dr. podría responder a la siguiente pregunta
Es posible que en la electroforesis se vean bandas que no corresponden a la amplificación de los primers utilizados? a que se debe?
Gracias de antemano
hola muy buen articulo. Me gustaria saber que reactivo causa que la PCR no amplifique, saludos.
Hola Nubia. La pregunta tiene fácil respuesta: si falta alguno de los reactivos base que componen la mezcla de amplificación (taq, buffer, magnesio, primers y ADN) en su correcta concentración, la PCR fallará. Ahora bien, si te refieres a alguno de los componentes específicos del buffer o si te ha fallado en algún momento la amplificación, entonces habría que estudiar de forma específica tanto la calidad del ADN que utilizas como el kit de PCR (en caso de utilizar uno de una casa comercial) y las concentraciones de cada componente.
Un saludo y gracias por tu comentario.
Hola muy buen artículo y excelentes respuestas .
Tengo una duda ya que estoy realizando PCR anidada para malaria aviar (amplificando un fragmento de 478 bp excluyendo los primers del citocromo b), y bueno al visualizar los fragmentos en el gel de agarosa al 1.5%, el control positivo me sale excelente, sin embargo para las demás muestras que podrían ser positivas me salen algunas banda tenues que no sé si sean positivas o no, que podría hacer para resolver esta duda, ya que para todos los casos se utiliza la misma concentración de ADN, saludos.
Hola Elfego. Perdona por tardar en contestar. Tendrías que darme algo más de información. Es una situación especial. Supuestamente el control positivo es uno comercial ¿verdad?. ¿tus muestras pueden tener algún contaminante debido al método de extracción?. Un saludo y ya me contarás (aunque espero hayas solucionado el problema en estos 15 días).
Hola, tengo una consulta: estoy trabajando en expresión génica diferencial, por lo cual corro geles en acrilamida (cDNA-AFLP), de ese gel corto bandas de interés y extraigo el ADN de esa banda y amplifico la banda. Cuando voy a chequear en agarosa esa amplificación siempre obtengo un chorreado. Pensé que podía ser por «suciedad» por lo que lo precipité, pero me sigue dando un chorreado. Además lo diluí de manera seriada y lo mismo. Que puede estar pasando???
hola, es muy buena explicacion lo único tengo unas dudas sobre el diseño de los cebadores ya que aunque pueden ser especificos he estudiado que pueden ser degenerados, aleatorios..además otro concepto que no entiendo es la amplificacion de fragmentos no específicos
hola necesito que me aconsejes con la siguiente duda. realizo hace varios años una pcr para diagnostico muy sensible y altamente especifica. Ultimamente esta fallando, no se amplifican todas las muestras que tienen que amplificar y algunas amplifican una banda con el doble de peso molecular de la esperada. Puede ayudarme?
HOLAAA—
Dr yo tengo una pregunta tengo un kit para hacer extracción y amplificacion de ADN de animales pero yo busco que aquellos primers me amplifiquen el ADN de un insecto como hago para comprobar si esos primers me puedan servir???? (Obvio antes de comprar el Kit) xfaa necesito ayuda urgente)!!!!
Hola, Kim. En primer lugar, si es un Kit de amplificación junto con el Kit de extracción (porque según has redactado este comentario, dudo de ello) tendrán unos primers definidos. Si esos primers no son para amplificar el ADN de un insecto, no puedes buscar nada puesto que van a amplificar una zona ya asignada por la casa comercial. Lo más inteligente sería diseñar unos cebadores específicos para ese insecto.
Un saludo .
hola estoy realizando una caracterización en algodón y el peso de los alelos(bandas) me da mucho mas altos en referencia a otras investigaciones, tenes idea porque puede estar ocurriendo esto?
Hola, Lorena. Podrían ser secuencias variables y el diseño de los cebadores podría originar esas diferencias. Antes de nada, ¿qué tipo de fragmentos estás intentando amplificar y qué referencias tomas como base?. Un saludo.
Como saber cuantos pares de bases amplifica un par de primers u oligos?.
Estimado sr.:
Tengo mucho interés en hablar con vd. en privado. Escríbame por favor a mi correo para poder comentar con vd. un asunto.
Un cordial saludo.
¿Porque algunas veces no llega a amplificar el adn?
Buenas tardes,
en la mayoría de protocolos que tengo, cuando se prepara la mezcla máster (master mix) se hace por el número de ciclos que se vaya a programar el termociclador + un control negativo, por ejemplo, dan la cantidad de cada componente de la mezcla para un tubo y si la técnica se realizará en 20 ciclos, esas cantidades se multiplican x21 para preparar toda la cantidad de mezcla máster. Mi pregunta es, ¿Por qué se prepara un tubo por cada ciclo? Gracias.
Cuál podría ser la causa de que un DNA genómico amplifique más arriba de la banda que le corresponde si no tiene intrones???
Corrí 4 muestras de DNA g (misma muestra, diferentes réplicas), dos amplificaron en la banda que correspondía 694 pb y 2 un poco más arriba (> a 750 pb y menor a 900 pb), pero mucho más nítidas que las otras dos.
La calidad relación 260/280 de las 4 muestras estaba ok. concentración parecida y con integridad buena.
Muchas gracias